同济大学陈杨提出基于营养素纳米化技术的肿瘤代谢重激活治疗新策略,研究成果发表于《自然-纳米技术》
不受控的快速增殖是癌细胞区别于正常细胞的关键特征。在癌细胞中,以大分子合成及细胞分裂为目的的能量代谢通路被异常激活,而与增殖无关的代谢通路则受到抑制。从恢复癌细胞正常代谢的角度出发,研究者们发现了肿瘤治疗的重要靶点。但迄今为止,绝大多数靶向代谢的药物和疗法,均聚焦于抑制过度激活的代谢通路,而多种代谢通路之间的代偿效应严重阻碍了该思路的临床疗效。
近日,同济大学生命科学与技术学院助理教授陈杨在Nature旗下刊物《自然-纳米技术》(Nature Nanotechnology)上,创新性提出了基于营养素纳米化技术的肿瘤代谢重激活新策略,并以黑色素瘤为例揭示通过纳米营养素激活癌细胞被抑制的代谢通路,同样展现出令人振奋的抗癌效果,并有助于临床的联合治疗,从而为肿瘤治疗提供全新范式。
研究者们首先指出,针对不同肿瘤如何选择受抑制的代谢通路进行激活,是该策略的重中之重。在此,他们发现,肿瘤细胞中大多数受抑制的代谢通路,是肿瘤起源组织-细胞类型特异性代谢。例如,皮肤黑色素瘤(SKCM)起源于黑色素细胞,合成及分泌黑色素是其重要的功能。而在晚期及转移性SKCM患者中,黑色素合成代谢通路显著下调,并且与患者生存期呈负相关。
而能否高效、特异性激活目标代谢,是该策略成功与否的关键。在该研究中,研究人员并未大规模筛选酶激活剂,而是巧妙地将目光投向机体所需的营养物质,如氨基酸、糖类、维生素等,因其可作为天然底物激活特定的代谢通路。然而,小分子营养物质在体内的生物利用度十分有限,采用常规手段无法在癌细胞内补充具有治疗剂量的营养物质实现对特定通路的高效激活。为了解决这一技术瓶颈,研究人员创新性提出营养物质纳米化的新技术,即仅仅利用机体中已有的营养小分子构建纳米营养素,在短时间内数倍提升胞内特定营养物质的含量,从而显著激活癌细胞被抑制的代谢通路。
针对黑色素瘤,该研究以黑色素合成底物酪氨酸为基础,合成了不饱和脂肪酸-酪氨酸-甘露糖三嵌段两亲分子,通过自组装得到靶向黑色素瘤的可降解两亲纳米胶束,在12小时内显著提升胞内酪氨酸的含量约8倍(补充游离酪氨酸提高仅3倍),从而显著激活了黑色素瘤细胞的黑素合成及分泌。与此同时,黑色素瘤细胞增殖也得到了明显抑制。在机制方面,研究人员揭示:黑色素瘤的黑色素合成与糖酵解代谢之间存在相互作用。黑色素合成的中间代谢产物5,6-吲哚醌,可以抑制糖酵解关键酶-丙酮酸脱氢酶(PKM)的活性,从而干扰癌细胞糖代谢抑制其增殖(图1)。
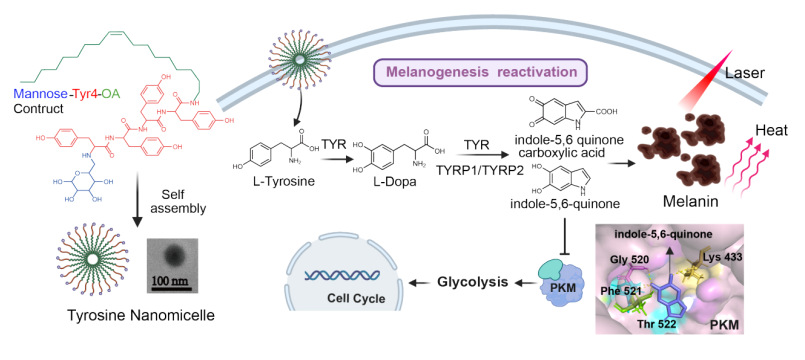
图1 基于营养素纳米化技术的肿瘤代谢重激活新策略用于黑色素瘤治疗
研究结果显示,酪氨酸纳米胶束在体内可靶向黑色素瘤(靶向效率4.4%),对小鼠和人来源的黑色素瘤(包括BRAF突变型/野生型)均发挥了较好的抗肿瘤效果,且对BRAF野生型肿瘤效果更好。研究指出,这可能与BRAF突变黑色素瘤中调控黑色素合成的转录因子MITF过度泛素化有关,从而为该纳米药物的临床应用提供了科学依据。更令人惊喜的是,黑化的黑色素瘤细胞表现出对热应激的抵抗下降。而黑色素作为一种天然的光热试剂,具有优异的光热转化性能从而有益于后续光热联合治疗。这说明,重新激活肿瘤代谢通路后在肿瘤内部大量积累的代谢产物和表型重塑,将有助于联合已有临床治疗手段实现协同抗癌。
总而言之,该项研究首次提出的基于营养物质纳米化技术的“代谢重激活”新策略,为肿瘤治疗开辟了新方向并提供了新技术方法,有望成为肿瘤代谢治疗的新范式。
同济大学生命科学与技术学院为该论文第一单位。助理教授陈杨、同济大学附属第十人民医院王超超副研究员和吴叶林研究员为论文的共同第一作者。复旦大学材料科学系/聚合物分子工程国家重点实验室步文博教授、澳大利亚悉尼科技大学/宁波东方理工大学(筹)金大勇院士、复旦大学附属华山医院皮肤科吴金峰教授为论文共同通讯作者。该研究工作得到了国家自然科学基金、上海市教委创新重大基础项目等经费支持。






